Artículo de Revisión
Revisión bibliográfica sobre el
uso de terapia de espejo para tratar el dolor fantasma de personas amputadas
F. Javier del Pozo Sancho1,
José María Rozas Martín2, Virginia Díaz Teruel3
1Diplomado en
Enfermería. Diplomado en Podología. Hospital Universitario 12 de Octubre.
Madrid. España.
2Diplomado
en Enfermería. Hospital Universitario 12 de Octubre. Madrid. España.
3MsC.
Diplomada en Enfermería. Hospital Universitario 12 de Octubre. Madrid. España.
Correspondencia
F.
Javier del Pozo Sancho.
Correo
electrónico: javipopter@hotmail.com
Recibido:
04/12/2018
Aceptado:
20/01/2019
RESUMEN
El dolor de miembro fantasma es una complicación frecuente tras la
amputación de un miembro. Su fisiopatología es compleja y el tratamiento
farmacológico disponible no es satisfactorio. Por ello, el foco de atención se
está desviando hacia terapias no farmacológicas como la terapia de espejo, una
técnica descrita en los años 90 por Ramachandran y que consiste en crear la
ilusión de estar viendo el miembro amputado mediante la observación del reflejo
del otro miembro en un espejo. Un estudio de 2007 concluía que es eficaz para
el tratamiento del dolor fantasma de amputados del miembro inferior. El
objetivo principal de este trabajo fue revisar la literatura científica más
reciente sobre la aplicación de la terapia de espejo para el tratamiento del
dolor fantasma de amputados. Como objetivos específicos, valorar la evidencia
científica que avala su uso; identificar contraindicaciones y efectos adversos;
analizar los protocolos de aplicación empleados, y averiguar si hay factores
individuales susceptibles de influir en la respuesta de los pacientes.
Mediante una búsqueda bibliográfica en Medline, Embase Cochrane
Library y Cuiden se localizaron y evaluaron dos revisiones sistemáticas y ocho
estudios primarios.
La terapia de espejo es una opción terapéutica económica, de fácil
aplicación, con pocas contraindicaciones y que no suele producir efectos
adversos severos, pero no se ha encontrado suficiente evidencia científica que
avale su uso en amputados. Hay muchas dudas con respecto a su mecanismo de
acción, forma idónea de aplicación y eficacia. Es necesario realizar más
estudios.
PALABRAS CLAVE
Terapia de espejo; Amputación; Dolor de miembro
fantasma.
SUMMARY
Phantom limb pain is a common
complication after a limb amputation. Its pathophysiology is complex and the
pharmacological treatment available is not satisfactory. So, the focus is being
diverted towards non-pharmacological therapies such as mirror therapy, a
technique described in the 90s by Ramachandran that consists in creating the
illusion of seeing the amputated limb by visualizing the reflection of the
existing limb in a mirror. A study published in 2007 concluded that it is
effective for the treatment of phantom pain in patients with lower limb
amputation. The main objective of this work was to review the most recent
scientific literature on the application of mirror therapy for the treatment of
phantom pain of amputees. As specific objectives, assess the scientific
evidence that supports its use, identify contraindications and adverse effects,
analyze the application protocols used, and find out if there are individual
factors that could influence the response of patients.
Through a bibliographic search in
Medline, Embase, Cochrane Library and Cuiden were located and evaluated two
systematic reviews and eight primary studies. Mirror therapy is an affordable
therapeutic option, easy to apply, with few contraindications and which does
not usually produce severe adverse effects, but not enough scientific evidence
has been found to support its use in amputees. There are many doubts regarding
its mechanism of action, best form of application and effectiveness. It is
necessary to carry out more studies.
KEY WORDS
Mirror
therapy; Amputees; Phantom limb.
Introducción
Las
principales causas de amputación en personas mayores de cincuenta años son las
enfermedades vasculares, la diabetes, el cáncer y las infecciones. Respecto a
la amputación en personas más jóvenes, las principales causas se atribuyen a
accidentes y traumatismos. Una de las principales dificultades que se presenta
tras las amputaciones es el dolor de miembro fantasma (DMF) (1). Es fundamental
distinguir los distintos tipos de sensaciones que puede tener el paciente
amputado. Dolor en el miembro residual es aquel que se origina en el segmento no
amputado; puede ser ocasionado por dolor propio de la cirugía, neuromas,
infecciones, etc. Miembro fantasma es la percepción no dolorosa del segmento
amputado. El DMF es la percepción dolorosa que se origina en el área
correspondiente al segmento amputado tras una amputación (2).
Casi
todos los amputados refieren sensación de miembro fantasma (MF). Un 50-80% se
quejan de dolor de DMF (3).
El
DMF suele aparecer en el posoperatorio inmediato. A veces se cronifica,
existiendo gran variabilidad en cuanto a su intensidad, frecuencia y tipología.
La frecuencia e intensidad de los episodios suele ir disminuyendo con el
tiempo, pero aproximadamente el 5-10% de los amputados siente dolor severo,
intratable e inhabilitante durante muchos años (4). Es posible que el DMF esté
relacionado con la causa de amputación. Es más frecuente en adultos que en
niños, y prácticamente no existe en amputados congénitos (5). Se ha sugerido
que ciertos factores, como el dolor persistente preoperatorio, podrían
contribuir a su aparición. Hay estudios centrados en la prevención mediante el
tratamiento del dolor pre y posoperatorio, pero los resultados han sido
ambiguos y sugieren que ese tipo de medidas no son eficaces (3).
Inicialmente, el DMF fue considerado un tipo de trastorno
psicológico (6). Pero parece que, en el posoperatorio inmediato, no está
relacionado con factores como la depresión, la ansiedad, la negación o el
duelo. Posteriormente, la depresión y la ansiedad sí podrían contribuir al DMF,
pero en menor grado que en otros tipos de dolor crónico (7).
La
amputación induce cambios en el sistema nervioso y en el periférico. Por eso el
DMF a veces es considerado como dolor neuropático (3). Su fisiopatología es
compleja e incluye cambios en el nervio periférico, los ganglios de la raíz
dorsal, la médula espinal y la corteza cerebral (8). Tras la amputación, la
pérdida de información sensorial aferente podría permitir que la zona de la corteza
sensoriomotora donde estaba representado ese miembro sea invadida por regiones
corticales colindantes. Hay una estrecha relación entre la cantidad de
reorganización cortical y la intensidad del DMF de los amputados (7). Revertir
los cambios que se producen en la plasticidad cerebral tras la amputación
podría prevenir o reducir el DMF. Esta perspectiva ha generado enfoques
terapéuticos como la discriminación sensorial o la terapia de espejo (TE) (9).
Makin et al. (10)
sugieren que los cambios cerebrales de los amputados podrían ser inducidos por
el dolor y, por lo tanto, el DMF estaría asociado con representaciones
estructurales y funcionales conservadas en el área del córtex correspondiente
al miembro amputado. Ninguna de estos constructos teóricos parece ser capaz de
explicar por sí mismo el fenómeno del DMF, y muchos expertos creen que hay
múltiples mecanismos implicados.
Desgraciadamente,
el tratamiento farmacológico habitualmente empleado está lejos de poder ser
considerado satisfactorio. Una Revisión Cochrane de 2016 (11) concluye que hay
muchas dudas sobre la eficacia y seguridad del arsenal terapéutico disponible.
Debido a esta falta de evidencia, el foco de atención se está desviando hacia
tratamientos basados en terapias no farmacológicas como la terapia de espejo
(TE).
En
1993 Ramachandran et al. postularon
la TE como solución al problema del DMF, que consiste en crear la ilusión de
estar moviendo el miembro amputado mediante la visualización del reflejo de los
movimientos del miembro existente en un espejo. Este estímulo visual aliviaba
el dolor (12). Un estudio de 2007 (13) concluía que la TE es eficaz para el
tratamiento del DMF de los pacientes que han sufrido una amputación del miembro
inferior.
El
DMF afecta a los pacientes amputados independientemente del motivo de
amputación, pero el tipo y la duración de la enfermedad preexistente podría
tener cierto impacto sobre la respuesta de los pacientes al tratamiento (14).
Algunos estudios sugieren que la respuesta a la TE podría depender de características
individuales como la intensidad del dolor, el tipo de dolor y el sexo.
Se
han propuesto diferentes mecanismos para explicar el efecto de la TE,
incluyendo que produce reorganización cortical, reenlace de los sistemas motor
y visual, activación de las neuronas espejo, modulación de las rutas del dolor,
despertar de memorias propioceptivas, o la reversión de un potencial síndrome
de negación (3).
La
previsión es que el número de amputaciones vaya en aumento, y buena parte de
estos pacientes van a desarrollar DMF. Por lo tanto, resulta imperioso identificar
la mejor forma de abordar este problema. La TE está obteniendo resultados
aparentemente favorables, pero su uso no aparece recogido en ninguna guía de
práctica clínica.
El
objetivo principal de este trabajo fue revisar la literatura científica más
reciente sobre la aplicación de la TE para el tratamiento del DMF de los
pacientes amputados. Como objetivos específicos, valorar la evidencia
científica que avala su uso; identificar contraindicaciones y efectos adversos;
analizar los protocolos de aplicación empleados, y averiguar si hay factores
individuales susceptibles de influir en la respuesta de los pacientes a la
terapia.
Material y método
En
septiembre de 2018 se realizó una búsqueda bibliográfica en Medline, Embase
Cochrane Library y Cuiden. Se utilizó una mezcla de lenguaje libre y controlado,
mediante los siguientes términos de búsqueda: terapia de espejo (mirror
therapy); dolor de miembro fantasma (phantom limb pain/ phantom pain); amputación
(amputation). Para la combinación de estos términos se empleó el operador
booleano AND. La búsqueda se limitó a los últimos cinco años.
La
estrategia utilizada en PubMed fue: ((mirror therapy) AND (phantom limb pain)
AND (amput*)).
Los
artículos localizados fueron valorados inicialmente a partir del resumen. Los
artículos duplicados fueron eliminados, y aquellos que cumplían los criterios
de inclusión fueron valorados mediante lectura del texto completo.
Criterios
de inclusión: artículos originales publicados en inglés o español entre enero
de 2014 y septiembre de 2018 relativos a la aplicación de la TE en el
tratamiento del DMF de pacientes amputados.
Criterios de exclusión: artículos teóricos; artículos ya
incluidos en alguna de las revisiones sistemáticas (RS); estudios descriptivos;
artículos de casos; revisiones no sistemáticas; estudios sobre población
pediátrica; estudios sobre no amputados; estudios sobre pacientes biamputados;
estudios realizados con tecnologías de realidad virtual o de realidad
aumentada; estudios que simultaneaban la TE con la administración de algún otro
tratamiento que no estaba recibiendo el paciente previamente; protocolos de
estudios sin resultados.
Además,
se consultaron las listas de referencias de algunos de los artículos hallados y
se realizó una búsqueda manual en Google Académico.
De
las revisiones halladas se recopiló, inicialmente, la siguiente información:
autor y año de publicación, país, objetivos y metodología. Dada la
heterogeneidad de las mismas en cuanto a objetivos, se extrajo solo la
información relativa a la aplicación de la TE para el tratamiento del DMF de
los amputados: variables relacionadas con la valoración del DMF, variables
demográficas, otros factores individuales considerados, formas de aplicación de
la terapia, contraindicaciones, efectos adversos, número y tipo de estudios
considerados para valorar la eficacia de la TE, número de participantes en los
estudios, resultados y conclusiones del autor.
De
los estudios primarios se recogió la siguiente información: autor principal,
año de publicación, país, objetivo del estudio, tipo de estudio, número de participantes,
variables demográficas, variables relacionadas con el miembro amputado,
intervenciones realizadas, escalas de valoración del dolor empleadas, otras
variables relacionadas con la valoración del DMF, tiempo de seguimiento,
contraindicaciones, efectos adversos, y resultados. Cada artículo fue
considerado por separado. De los estudios que tenían varios objetivos tan solo
se valoró la información coincidente con los objetivos de esta revisión.
Para
valorar la evidencia sobre la eficacia de la TE en el tratamiento del DMF de
amputados solo se consideraron los ECA y las RS. Todos estos estudios fueron
sometidos a un proceso de lectura crítica para determinar su calidad.
El
análisis de datos se realiza mediante desarrollo narrativo.
Resultado y
discusión
De
71 referencias localizadas, 61 se eliminaron por estar duplicadas, por no
cumplir los criterios de inclusión, por presentar criterios de exclusión, o
porque no se pudo acceder al texto completo.
Entre
los diez estudios finalmente incluidos había dos RS (15) (16), cuatro ECA (17) (18)
(19) (20), tres estudios cuasiexperimentales sin grupo control (21) (22) (23),
y un retrospectivo de dos estudios de cohortes (24).
Uno
fue publicado en 2015 (17), dos en 2016 (15-21), cuatro en 2017 (18-19-22-24),
y tres en 2018 (16-20-23).
Cinco
de los estudios se realizaron en Asia: dos en India (17-19), uno en Turquía
(21), uno en Japón (22) y uno en Camboya (23); dos en América: EE. UU. (18,24).
Tres en Europa: España (16), Holanda (20) y Francia (15). Todos se publicaron
en inglés.
Pubmed
ofreció 43 resultados, pero antes de aplicar los filtros temporales había
ofrecido 95. De esto se deduce que hay un interés creciente por este asunto,
muy especialmente en países asiáticos. Esto está en consonancia con el hallazgo
de Barbin (15), que detecta un importante aumento en la publicación de
artículos relativos al uso de la TE en pacientes amputados a partir de 2009.
El
número de estudios incluidos en esta revisión es bajo. Esto, en parte, se puede
explicar porque los criterios de inclusión y exclusión fueron muy estrictos, y
se eliminaron estudios que aplicaban diferentes intervenciones en combinación
con la TE, lo cual se consideró que podía impedir la interpretación correcta de
los resultados. Se hizo una excepción con el ECA de Rothgangel (20) porque,
aunque incorporaba técnicas de realidad aumentada, ofrecía resultados relativos
a pacientes tratados únicamente con TE. El estudio de Tilak (17), aunque ya
había sido evaluado en las RS halladas, finalmente fue considerado al
comprobarse que dichas revisiones no eran de calidad.
Formas
de aplicación de la TE
La
TE consiste en colocar un espejo delante del paciente en posición parasagital
para crear la ilusión de que ha recuperado el miembro amputado. Durante la
terapia se le pide al paciente que ejecute movimientos con ambos miembros
(tiene que imaginar que mueve el miembro amputado) mientras observa el conjunto
formado por el miembro sano y la imagen formada en el espejo.
La
Tabla 1 incluye los protocolos utilizados en los ECA de Finn (18), Tilak (17),
Ramadugu (19) y Rothgangel (20).
La Tabla 2
recoge otros protocolos extraídos de las RS.
Griffin
(24), en su estudio retrospectivo de dos cohortes de 31 pacientes, tan solo
indica que los participantes recibieron una media de diecinueve sesiones de
quince minutos, con un rango de entre tres y cuarenta sesiones.
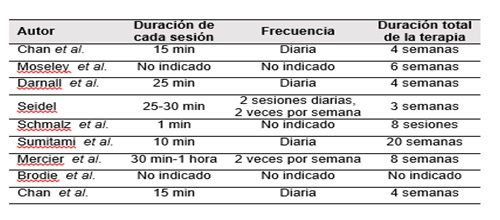
Tabla
2. Protocolos empleados en otros ECA incluidos en las RS.
Se
ha detectado gran variabilidad en los protocolos de aplicación, tanto en el
número y duración de las sesiones como en su frecuencia. Este hallazgo confirma
lo detectado por Hagenberg (12).
A
pesar de que podría ser un punto clave en la eficacia de la terapia, tan solo
Rothgangel (20) explica en qué se basó para elaborar su protocolo.
Los
protocolos difieren también en otros aspectos: Finn (18) pedía a los pacientes
que empezasen realizando movimientos lentos con la mano sana para que la mano
fantasma pudiese seguir el ritmo, y que fuesen ampliando gradualmente el rango
de movimientos si la mano fantasma tenía movilidad limitada.
Tilak
(17) les pedía realizar movimientos sencillos con el miembro no amputado.
Ramadugu (19) les pedía que moviesen el miembro sano y el amputado simultáneamente
mientras realizaban cinco tipos de ejercicios.
Rothgangel,
antes de iniciar su estudio, definió y publicó un marco clínico para la
aplicación de TE (25) que recoge las características que deben cumplir los
pacientes, los objetivos que debe buscar la terapia, qué hacer si aparecen
efectos adversos y qué información debe recibir el paciente. También da
recomendaciones sobre el espejo y otros materiales necesarios (además de
ejercicios motores se incluyen ejercicios sensoriales) y sobre la sala donde se
realice la TE. Además, explica con qué frecuencia se debe aplicar, qué duración
debe tener cada sesión y cómo finalizar las sesiones.
Barbin
(15) recoge sugerencias como: informar previamente al paciente sobre el
procedimiento; que el paciente adopte una posición cómoda en un lugar tranquilo
para facilitar la concentración; que el miembro sano se refleje por completo en
el espejo; que la parte residual del amputado quede oculta; empezar con una
fase en la que el paciente solo observa el reflejo sin realizar movimientos.
Herrador (16) solo recomienda que los ejercicios sean bilaterales, disminuyendo
la tensión muscular y relajando la parte residual del miembro amputado.
Efectos
adversos y contraindicaciones
De
los siete estudios primarios incluidos, tan solo el de Rothgangel (20) detecta
efectos adversos: dos pacientes tuvieron sensación de náuseas, incremento en la
sudoración y reacción emocional al principio del tratamiento. Ramadugu (19)
deja constancia expresa de que no se produjeron efectos adversos. En los demás
estudios no queda claro si realmente no se produjeron o si no se detectaron
porque no formaba parte de los objetivos declarados. Barbin (15) expone que los
efectos adversos de la TE son frecuentes, en particular los episodios de
confusión y mareo, y que se han descrito casos de aumento del dolor e incluso agravamiento
de un síndrome depresivo.
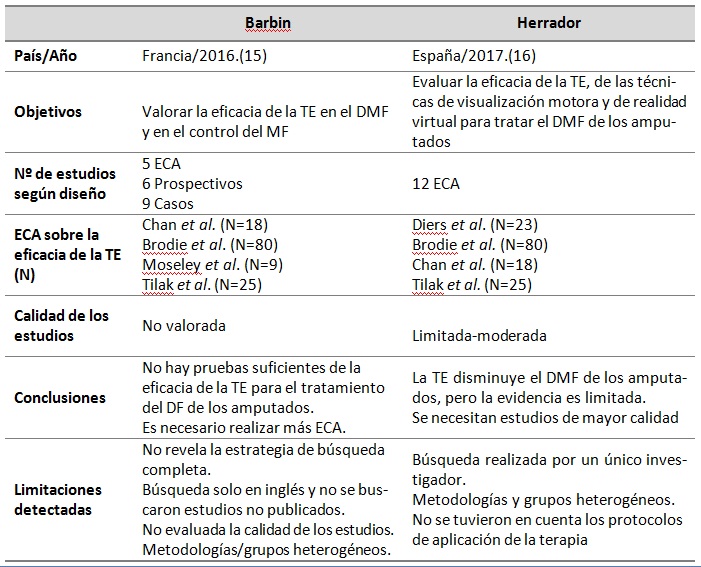
Tabla
3. Síntesis de las RS halladas.
Estos hallazgos concuerdan con lo expresado por
Hagenberg (12): Los efectos adversos suelen ser ligeros, aunque a veces llegan
a ser severos, e incluyen reacciones emocionales, aumento del dolor,
alteraciones sensoriales, mareo, náuseas, sensación de miembro telescópico
(percepción alterada de la longitud del miembro), inmovilización del MF,
sudoración generalizada, sudoración del MF y movimientos espontáneos del MF.
Según
Barbin (15), las contraindicaciones más frecuentemente mencionadas son la
presencia de alteraciones neurológicas o psicológicas, dolor en el miembro
existente y los problemas de visión. Este hallazgo está en consonancia con el
hecho de que, en los ECA analizados, los autores utilizan este tipo de factores
como motivos de exclusión.
Eficacia de la TE en el
tratamiento del DMF de los amputados
Para
analizar este aspecto se han comparado seis estudios muy diferentes en cuanto a
objetivos, metodología y calidad, pero según el Manual Metodológico de elaboración
de GPC del SNS (26), para hallar evidencia a menudo hay que integrar los
resultados de estudios heterogéneos.
A. Evidencia aportada por estudios secundarios
Se valoraron dos RS(15-16), la Tabla 3 sintetiza la información
recabada. Ambas RS pretendían valorar la eficacia de
la TE para el tratamiento del DMF de los amputados. Barbin (15) no
encuentra
ninguna prueba de la eficacia de la TE; Herrador (16) dice que es
eficaz, pero
con evidencia limitada. Esta diferencia puede deberse a que Herrador
solo
consideró los estudios de mayor calidad. Además, para
este autor, los
mecanismos cerebrales implicados en la TE convencional, en la TE
virtual y en
las técnicas de visualización motora son similares, y por
eso incluyó estudios
que utilizaban intervenciones potencialmente distintas. Pero es muy
posible que
los cambios en la plasticidad cerebral inducidos por un estímulo
visual real no
sean equiparables a los inducidos por estímulos
imaginados. Por otro lado, las terapias con realidad virtual requieren una
sofisticada y costosa tecnología que la hace inaccesible para muchos pacientes
(8).
Herrador (16) utilizó estudios de calidad limitada, y
Barbin (15) ni siquiera determinó la validez de los estudios (solo estimó la
calidad de la evidencia que aportaban en base al tipo de diseño). Debido a
estas y otras limitaciones que recoge la Tabla 3, no se puede considerar que
estos trabajos tengan buena calidad metodológica y, por tanto, la evidencia que
aportan es limitada.
B. Evidencia aportada por
los estudios primarios de mayor calidad
Un
total de 205 pacientes participaron en los 4 ECA (17-18-19-20) considerados en
esta revisión. El 62,7% de los mismos (n= 168) eran hombres. En la Tabla 1 queda resumida la metodología de cada estudio.
Con respecto a la forma de valorar el DMF, todos los
estudios medían la intensidad del dolor mediante alguna escala validada. Tres
de los cuatro estudios también valoraban la frecuencia y duración de los
episodios de dolor. Pero a la hora de valorar el efecto de la TE, los
investigadores no tuvieron en cuenta las preferencias de los pacientes. Esto
podría ser importante porque, por lo variable que es este tipo de dolor en
cuanto a su forma de aparición, habrá pacientes que prefieran que el objetivo
del tratamiento sea reducir la frecuencia y duración de los episodios en vez de
disminuir la intensidad (4).
Tres ECA (17-18-19) determinan que la TE es eficaz en el
tratamiento del DMF de los amputados, y uno (20) concluye que cuatro semanas de
TE tienen un efecto ligeramente positivo, no significativo estadísticamente,
sobre la duración e intensidad de los episodios de DMF.
En cuanto a la valoración metodológica de estos estudios,
todos utilizaron un sistema de muestreo por conveniencia. Las muestras eran muy
pequeñas, y fueron aleatorizadas en base a criterios como el sexo, la edad o el
tipo de amputación, pero incluían individuos muy heterogéneos con respecto a
otras variables como el valor basal de DMF y la causa o la antigüedad de la
amputación, lo cual podría condicionar los resultados obtenidos. Otro aspecto
que puede afectar a los resultados y a su interpretación es la variabilidad en
los protocolos usados y en el tiempo de seguimiento de los pacientes. En este
sentido, Griffin (24) sugiere que los pacientes con DMF leve podrían necesitar
siete sesiones para que el tratamiento sea efectivo; los pacientes con dolor
medio necesitarían catorce sesiones, y los pacientes con dolor intenso
necesitarían un mínimo de veintiuna sesiones.
Los
estudios sobre TE solo pueden ser de simple ciego porque ni los pacientes ni los
terapeutas pueden ser cegados, pero el estudio de Finn (18) ni siquiera cumple
ese requisito. Además, los pacientes del grupo control de ese estudio pasaron
al grupo experimental antes de finalizar el tiempo previsto.
Debido
al escaso tiempo de seguimiento de los pacientes ningún estudio pudo determinar
si la disminución del DMF se mantenía a largo plazo.
De
todo este análisis se deduce que la evidencia aportada es limitada porque tanto
la validez interna como la validez externa de estos estudios es cuestionable.
El ECA de Rothgangel es el que presenta mejor calidad metodológica, pero, aun
así, no alcanzó el tamaño muestral previsto.
Factores individuales que
condicionan la respuesta a la TE
La Tabla 1 recoge las variables relacionados con el DMF y
con la amputación de cada estudio. Cabe suponer que los investigadores
eligieron esas variables porque pensaban que esos factores condicionan el grado
de respuesta de los pacientes a la terapia, pero debido a los, en general,
pequeños tamaños muestrales, no pudieron analizar los resultados de los
subgrupos. Rothgangel (20) encuentra que la TE es más eficaz en mujeres y en
amputados que refieren sensación de miembro telescópico, pero también señala
que cualquier conclusión sacada del análisis de los resultados de los subgrupos
de una muestra pequeña debe ser interpretada con cautela.
Implicaciones para la práctica
Tanto
la naturaleza del DMF como el mecanismo de acción de la TE siguen sin
comprenderse por completo. No hay consenso sobre protocolos de aplicación ni se
sabe si hay grupos de pacientes más susceptibles de beneficiarse de sus efectos
que otros, puesto que no se han podido identificar factores individuales que
condicionen la respuesta.
La
TE parece una opción terapéutica económica y de bajo riesgo. Ciertos indicios
sugieren que podría ser eficaz, pero, con la evidencia hallada, de momento no
es posible recomendar su uso para el tratamiento del DMF de pacientes
amputados.
Se
debe señalar que esta revisión presenta ciertas limitaciones. Algunas de ellas
eran inevitables porque son inherentes a toda revisión narrativa, pero también
se debe destacar que la búsqueda bibliográfica fue realizada por un único
investigador, y que los artículos hallados eran muy heterogéneos.
Conclusiones
No hay suficiente evidencia científica que avale el uso
de la TE para el tratamiento del DMF de pacientes amputados. Es una opción
terapéutica económica, de fácil aplicación, escasas contraindicaciones y que no
suele producir efectos adversos severos, pero hay muchas dudas con respecto a
su mecanismo de acción, forma idónea de aplicación y eficacia. También se
desconoce qué grupos de pacientes podrían beneficiarse más de sus efectos.
Se
necesitan más ECA realizados con tamaños muestrales adecuados, grupos de
pacientes homogéneos e intervenciones similares.
A
falta de consenso sobre la mejor forma de aplicación de la TE, el marco clínico
desarrollado por Rothgangel et al. se
postula como un buen referente.
Bibliografía
1. Tavera J. Amputación: Más Allá de un Cambio Físico, un Cambio
Mental. Rev El Dolor [Internet]. 2014;(62):20–2. Disponible en:
https://www.ached.cl/upfiles/revistas/documentos/55dddb2d3e34c_original3_62_final.pdf
2. Villaseñor Moreno JC, Escobar Reyes VH,
Sánchez Ortiz ÁO, Quintero Gómez IJ. Dolor de miembro fantasma: fisiopatología
y tratamiento. Rev Espec Médico-Qui-rúrgicas [Internet]. 2014;19(1):62–8.
Available from:
https://www.redalyc.org/html/473/47330738010/
3. Richardson C, Kulkarni J.
A review of the management of phantom limb pain: challenges and solutions. J
Pain Res. 2017;10:1861–70.
4. Nikolajsen L, Christensen
KF, Haroutiunian S. Phantom limb pain: treatment strategies. Pain Manag.
2013;3(6):421–4.
5. Flor H, Nikolajsen L,
Staehelin Jensen T. Phantom limb pain: a case of maladaptive CNS plasticity?
Nat Rev Neurosci. 2006;7(11):873–81.
6. Richardson C. Nursing
aspects of phantom limb pain following amputation. Br J Nurs. 2008;17(7):422–6.
7. Fuchs X, Flor H,
Bekrater-Bodmann R. Psychological Factors Associated with Phantom Limb Pain: A
Review of Recent Findings. Pain Res
Manag. 2018; 2018:5080123.
8. Lenggenhager B, Arnold CA, Giummarra MJ. Phantom limbs: pain, embodiment, and
scientific advances in integrative therapies. Wiley Interdiscip Rev Cogn Sci.
2014 ;5(2):221–31.
9. Flor H, Diers M, Andoh J.
The neural basis of phantom limb pain. Trends Cogn Sci. 2013;17(7):307–8.
10. Makin TR, Scholz J,
Filippini N, Henderson Slater D, Tracey I, Johansen-Berg H. Phantom pain is associated
with preserved structure and function in the former hand area. Nat Commun.
2013;4(1):1570.
11. Alviar MJM, Hale T, Lim-Dungca M. Pharmacologic interventions for
treating phantom limb pain. Cochrane Database Syst Rev. 2016;(10).
12. Hagenberg A, Carpenter C.
Mirror Visual Feedback for Phantom Pain: International Experience on Modalities
and Adverse Effects Discussed by an Expert Panel: A Delphi Study. PM&R.
2014;6(8):708–15.
13. Chan BL, Witt R, Charrow
AP, Magee A, Howard R, Pasquina PF, et al. Mirror Therapy for Phantom Limb
Pain. N Engl J Med. 2007;357(21):2206–7.
14. Datta R, Dhar M. Mirror
therapy: An adjunct to conventional pharmacotherapy in phantom limb pain. J
Anaesthesiol Clin Pharmacol. 2015;31(4):575.
15. Barbin J, Seetha V,
Casillas JM, Paysant J, Pérennou D. The effects of mirror therapy on pain and
motor control of phantom limb in amputees: A systematic review. Ann Phys
Rehabil Med. 2016;59(4):270–5.
16. Herrador Colmenero L, Perez Marmol JM,
Martí-García C, Querol Zaldivar M de los Á, Tapia Haro RM, Castro Sánchez AM,
et al. Effectiveness of mirror therapy, motor imagery, and virtual feedback on
phantom limb pain following amputation: A systematic review. Prosthet Orthot
Int. 2018;42(3): 288–98.
17. Tilak M, Isaac SA,
Fletcher J, Vasanthan LT, Subbaiah RS, Babu A, et al. Mirror Therapy and
Transcuta-neous Electrical Nerve Stimulation for Management of Phantom Limb
Pain in Amputees - A Single Blinded Randomized Controlled Trial. Physiother Res
Int. 2016;21(2):109–15.
18. Finn SB, Perry BN,
Clasing JE, Walters LS, Jarzombek SL, Curran S, et al. A Randomized, Controlled
Trial of Mirror Therapy for Upper Extremity Phantom Limb Pain in Male Amputees.
Front Neurol. 2017;8:267.
19. Ramadugu S, Nagabushnam
SC, Katuwal N, Chatterjee K. Intervention for phantom limb pain: A randomized
single crossover study of mirror therapy. Indian J Psychiatry.
2017;59(4):457–64.
20. Rothgangel A, Braun S,
Winkens B, Beurskens A, Smeets R. Traditional and augmented reality mirror therapy
for patients with chronic phantom limb pain (PACT study): results of a
three-group, multicentre single-blind randomized controlled trial. Clin Rehabil.
2018;32(12):1591–608.
21. Yıldırım M, Kanan N. The
Effect of Mirror Therapy on the Management of Phantom Limb Pain. Agri.
2016;28(3):127–34.
22. Ol HS, Van Heng Y,
Danielsson L, Husum H. Mirror therapy for phantom limb and stump pain: a randomized
controlled clinical trial in landmine amputees in Cambodia. Scand J Pain.
2018;18(4):603–10.
23. Imaizumi S, Asai T,
Koyama S. Agency over Phantom Limb Enhanced by Short-Term Mirror Therapy. Front
Hum Neurosci. 2017;11:483.
24. Griffin SC, Curran S,
Chan AWY, Finn SB, Baker CI, Pasquina PF, et al. Trajectory of phantom limb
pain relief using mirror therapy: Retrospective analysis of two studies. Scand
J Pain. 2017;15(1):98–103.
25. Rothgangel A, Braun S, de
Witte L, Beurskens A, Smeets R. Development of a Clinical Framework for Mirror
Therapy in Patients with Phantom Limb Pain: An Evidence-based Practice
Approach. Pain Pract. 2016;16(4):422–34.
26. Instituto Aragonés de Ciencias de la Salud. Elaboración de
guías de práctica clínica en el Sistema Nacional de Salud : manual metodológico.
[Internet]. Instituto Aragonés de Ciencias de la Salud; 2007 [cited 2019 May
2]. Available
from:
https://es.scribd.com/document/174868614/Manual-Metodologico-Elaboracion-GPC-en-El-SNS